产品概述
QuantiCyto® Human alpha-synuclein ELISA kit
Human
0.31ng/ml
0.63-40ng/ml
双抗体夹心法
比色法
血清、血浆、细胞培养上清液、灌洗液、尿液、羊水、腹水、脑脊液、胸腔积液、组织匀浆液等
100 μl/well
3.5h
用于体外定量检测血清、血浆或其他适用样品中天然及重组人alpha-synuclein浓度
本试剂盒特异性识别天然和重组人alpha-synuclein。
欣博盛QuantiCyto®ELISA试剂盒采用双抗体夹心法:抗人alpha-synuclein单抗包被于酶标板上,标本和标准品中的人alpha-synuclein会与单抗结合,游离的成分被洗去。加入生物素化的抗人alpha-synuclein抗体和辣根过氧化物酶标记的亲和素,生物素与亲和素特异性结合;抗人alpha-synuclein抗体与结合在单抗上的人alpha-synuclein结合而形成免疫复合物,游离的成分被洗去。加入显色底物,若反应孔中有人alpha-synuclein,辣根过氧化物酶会使无色的显色剂现蓝色,加终止液变黄。在450 nm处测OD值,人alpha-synuclein浓度与OD450值之间呈正比,可通过绘制标准曲线求出标本中人alpha-synuclein的浓度。
本产品仅供科研使用、不用于临床诊断。
产品性能
组分
| 名称 | 48T | 96T |
|---|---|---|
| 抗体预包被酶标板 | 8×6 | 8×12 |
| 冻干标准品 | 请以说明书为准 | 请以说明书为准 |
| 标准品&标本通用稀释液 | 12 ml×1 瓶 | 20 ml×1瓶 |
| 浓缩酶标抗体 | 1 支(规格见标签) | 1 支(规格见标签) |
| 酶标抗体稀释液 | 10 ml×1 瓶 | 16 ml×1 瓶 |
| 浓缩洗涤液20× | 25 ml×1 瓶 | 50 ml×1 瓶 |
| 显色底物(TMB) | 6 ml×1 瓶 | 12 ml×1 瓶 |
| 反应终止液 | 6 ml×1 瓶 | 12 ml×1 瓶 |
| 封板胶纸 | 3张 | 6张 |
| 产品说明书 | 1份 | 1份 |
运输温度
冰袋存放说明/保质期
| 未开封完整试剂盒 | 4℃,请在保质期内使用 | |
|---|---|---|
| 已开封试剂盒 | 抗体包被板条 | 未用完的板条放回带拉链铝箔袋封口 |
| 标准品 | 冻干粉-20℃可储存 6 个月左右,稀释后即用即弃 | |
| 浓缩生物素化抗体 | 浓缩液4℃可储存 1 个月左右,稀释后即用即弃 | |
| 浓缩酶结合物(避光) | ||
| 标准品&标本通用稀释液 | 4℃可储存 1 个月左右 | |
| 生物素化抗体稀释液 | ||
| 酶结合物稀释液 | ||
| 显色底物(避光) | ||
| 反应终止液 | ||
| 浓缩洗涤液20× |
已开封试剂盒效期特指试剂开盖后效期,如果仅拿出标准品置于-20℃,其他组分未启用,效期同未开封完整试剂盒。
文件下载
实验所需自备器材
1. 酶标仪(450 nm波长滤光片)。 2. 进口品牌高精度加液器及一次性吸头:0.5-10 ul, 2-20 ul, 20-200ul, 200-1000 ul。 3. 37 ℃恒温箱, 双蒸水或去离子水,坐标纸等。
相关数据
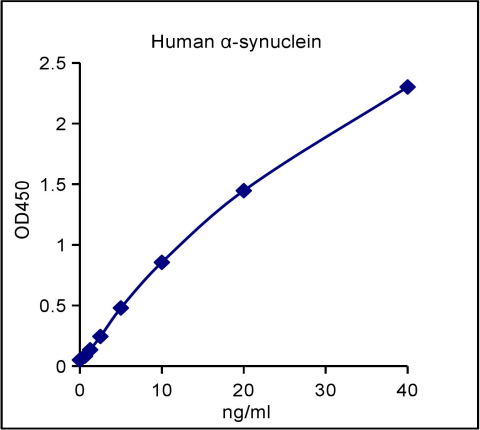
标准曲线
| Dose(ng/ml) | Raw Data | Average | Corrected | |
|---|---|---|---|---|
| 0 | 0.05 | 0.052 | 0.051 | |
| 0.63 | 0.085 | 0.08 | 0.083 | 0.032 |
| 1.25 | 0.137 | 0.133 | 0.135 | 0.084 |
| 2.5 | 0.247 | 0.242 | 0.245 | 0.194 |
| 5 | 0.483 | 0.477 | 0.480 | 0.429 |
| 10 | 0.861 | 0.851 | 0.856 | 0.805 |
| 20 | 1.451 | 1.442 | 1.447 | 1.396 |
| 40 | 2.310 | 2.294 | 2.302 | 2.251 |
注意:本图仅供参考,应以同次试验标准品所绘标准曲线计算标本中人α-synuclein的含量。
重复性
| 板内重复性 | 板间重复性 | |||||
|---|---|---|---|---|---|---|
| 样本 | 1 | 2 | 3 | 1 | 2 | 3 |
| 重复次数 | 10 | 10 | 10 | 8 | 8 | 8 |
| 平均值(ng/ml) | 33.4 | 14.3 | 3.6 | 21.8 | 8.1 | 2.7 |
| 标准差 | 2.5 | 1.1 | 0.3 | 1.7 | 0.6 | 0.2 |
| 变异系数(%) | 7.6 | 7.8 | 8.0 | 7.9 | 7.7 | 8.1 |
科研工具箱
别称
MGC110988; NACP; non A-beta component of AD amyloid; PARK1; PARK4; SNCA; synuclein alpha-140; synuclein, alpha (non A4 component of amyloid precursor)
基因ID
Gene ID: 6622
功能
突触核蛋白家族包括α-突触核蛋白、β-突触核蛋白、γ-突触核蛋白和突触素。这些高度保守的蛋白主要表达于大脑,集中在突触前神经末梢。α-突触核蛋白是一种可溶性蛋白质,该蛋白质由140个高度带电的氨基酸残基组成,其结构可分为三个功能域:N 末端(1-60 位氨基酸)含四个 KTKEGV 重复序列,介导蛋白与细胞膜的相互作用;中间疏水区域(NAC 结构域,61-95 位氨基酸)易形成β-折叠,是病理性聚集的核心位点;C 末端(96-140 位氨基酸)富含酸性残基,通过翻译后修饰(如磷酸化、泛素化)和金属离子结合维持蛋白溶解性,并调节其功能。正常状态下,α-突触核蛋白以单体形式存在,结合脂膜后可转化为α-螺旋结构,参与突触囊泡运输、神经递质释放等过程。病理状态下,α-突触核蛋白错误折叠形成低聚物、原纤维等聚集体,其传播机制与朊病毒类似,可通过细胞间传递加速病理进程。目前研究证实,异常聚集的α-突触核蛋白是帕金森病(PD)、路易体痴呆(DLB)的标志性病理物质,在阿尔茨海默病 (AD)患者脑内也观察到α-突触核蛋白沉积,但具体致病机制仍存在争议。研究发现,α-突触核蛋白与 tau 蛋白、β-淀粉样蛋白存在病理协同作用,三者的异常聚集可能共同驱动 AD 和 DLB 的神经退行性病变,提示多靶点治疗策略的必要性。
研究领域
神经科学


 加入
加入